Downloads
Download


This work is licensed under a Creative Commons Attribution 4.0 International License.
老年急诊重症肺炎患者血清CRP及NT-proBNP水平检测及临床意义
季蒙蒙
台前县人民医院,河南台前
摘要:目的:探讨老年急诊重症肺炎患者血清C-反应蛋白(CRP)及N-端脑钠肽前体(NT-proBNP)水平检测及临床意义。方法:选取2019年9月至2022年12月期间来我院就诊的肺炎患者86例作为本次的研究的对象,依据重症肺炎诊断标准将患者分为重症肺炎组(SP组)和非重症肺炎组(非SP组),另选同期来体检结果为正常的40例老年人作为对照组,收集所有对象一般资料,采集肺炎患者入院4小时、治疗后第3天、第5天、第7天以及体检者体检当天外周静脉血进行血清CRP、NT-proBNP含量检测,受试者工作特征曲线(ROC)评估血清CRP、NT-proBNP水平对重症肺炎的诊断价值。结果:SP组白细胞计数明显非SP组和对照组,SP组白细胞计数高于对照组(P < 0.05)。入院时SP组CRP、NT-proBNP水平明显高于非SP组和对照组,SP组CRP、NT-proBNP水平明显高于对照组(P < 0.05)。SP组及非SP组CRP、NT-proBNP水平组间、时间以及交互差异均有统计学意义(P < 0.05),SP组患者治疗第3 d、第5 d以及第7 d时血清CRP、NT-proBNP水平均高于同期非SP组(P < 0.05)。ROC曲线结果显示,CRP诊断重症肺炎的临界值为49.61 mg/L,曲线下面积为0.687,敏感度为54.55%,特异度为84.00%(P<0.05),NT-proBNP诊断重症肺炎的临界值为2069.76 pg/ml,曲线下面积为0.664,敏感度为100.00%,特异度为36.00%(P < 0.05),二者联合检测可提高预测效能,曲线下面积为0.701,敏感度为54.55%,特异度为85.33%(P < 0.05)。结论:血清CRP及NT-proBNP在老年重症肺炎患者血清中的含量显著升高,监测血清CRP、NT-proBNP水平有利于诊断和评估患者病情,二者联合检测诊断效能最佳。
重症肺炎(Severe pneumonia,SP)是指终末气道、肺泡以及肺间质等组织炎症发展恶化至一定阶段引起的危重症疾病,是ICU常见疾病的一种[1],临床危害性较大,患者可在短时间内出现低血氧症、休克、呼吸衰竭以及循环衰竭,死亡率可达53%~76%[2]。近些年来的报道发现,老年人群尤其是长期卧床的老年人是重症肺炎的易感人群,老年患者心肺功能较差,身体各项机能较差,发生重症肺炎的风险是中青年人群的10倍[3],严重威胁老年人群的生命周期和生存质量。因此,寻找能够在早期发现、及时评估病情及预后的有效标志物对于老年重症肺炎患者来说至关重要。C-反应蛋白(c-reactive protein,CRP)作为反映全身性炎症反应急性期的非特异性标志物,在脓毒症、急性胆囊炎、急性胰腺炎、急性上呼吸道感染等多种急性感染性疾病以及炎症性疾病的临床诊断和病情监测中均发挥重要作用[4]。N-端脑钠肽前体(N-terminal-pro-Brain natriuretic peptide,NT-proBNP)作为脑钠肽的氮末端-前体,是评价心功能和心室壁节段运动协调性的重要指标,对心功能敏感以及心力衰竭等疾病有较好的诊断价值[5],最新研究也发现,NT-proBN在非心源性所致的重症疾病患者外周血中的水平也显著增加[6]。本次研究探讨CRP和NT-proBNP在老年重症肺炎患者血清中的水平和在临床中的价值,希望为老年重症肺炎患者的早期诊断、治疗以及预后评估提供更多依据。
1 材料与方法
1.1 研究对象
选取2021年9月至2022年12月期间来我院就诊的肺炎患者86例作为本次的研究的对象,其中男性55例,女性31例;年龄为62~83岁,平均年龄(76.24±4.35)岁。另选同期来体检结果为正常的40例老年人作为对照组,其中男性28例,女性12例;年龄为60~82岁,平均年龄(75.98±3.69)岁。依据重症肺炎诊断标准将86例肺炎患者分为重症肺炎组(SP组)和非重症肺炎组(非SP组),SP组35例患者中男性22例,女性13例;年龄为63~82岁,平均年龄(76.13±4.79)岁。非SP组51例患者中男性33例,女性18例;年龄为62~83岁,平均年龄(76.28±4.56)岁。所有研究对象均对本次研究知情且同意。
1.2 纳入排除标准
纳入标准:(1)年龄均≥60周岁;(2)肺炎患者均为细菌性肺炎;(3)非SP组患者符合肺炎相关诊断标准[7],且满足下列第一项和后几项中任意一项:①CT或X线检查结果显示肺部有斑状或片状阴影及实变影;②发热;③新发咳嗽、咳痰或原呼吸道症状加重;④肺实变体征,有啰音或湿啰音;⑤伴或不伴肌肉酸痛、头痛;⑥白细胞计数>10×109/L或<4×109/L。(4)SP组患者符合重症肺炎相关诊断标准[8],且满足下列第一、二项中的任意一项或后几项中的三项:①辅助有创机械通气;②出现感染性休克,使用血管活性药物治疗;③多肺叶浸润;④氧合指数<250;⑤血小板<10×109/L;⑥白细胞计数<4×109/L;⑦体温<37℃;⑧呼吸频率≥30次/分;⑨意识模糊、血压过低。
排除标准:(1)合并肺栓塞、活动性肺结核、非感染性肺间质性疾病等其他肺部疾病者;(2)合并其他感染性疾病者;(3)合并免疫系统疾病或恶性肿瘤疾病者;(4)近期使用过免疫抑制剂或糖皮质激素者;(5)住院时间不足一周或预期生存期<48 h者;(6)一周内接受过抗感染药物治疗者。
1.3 标本采集
采集所有患者一般资料,包括性别、年龄、吸烟史、高血压史、糖尿病史等。于肺炎患者入院4小时内以及体检者体检当天抽取3管外周静脉血以进行血常规和血清CRP、NT-proBNP含量检测。此外,分别于SP组和非SP组患者入院治疗后第3天、第5天以及第7天采集晨起3管空腹外周静脉血再次进行血常规及血清因子含量测定。血液标本采集过程均严格按照操作规程进行,所有血样均在2小时内送至检验科进行检验。
1.4血清CRP、NT-proBNP含量检测
采用电化学发光免疫夹心法[9]以全自动荧光检测分析仪(厂家:法国梅里埃公司;型号:VIDAS30)以及其配套试剂盒检测血清中CRP和NT-proBNP含量,均严格按照说明书操作进行。血清CRP正常值不超过5 mg/L,75岁以下患者NT-proBN正常值不超过125 pg/ml,75岁以上患者NT-proBNP正常值不超过450 pg/ml。
1.5统计学分析
采用SPSS22.0软件对本次研究所有数据进行处理和分析,计量资料以“均数±标准差”表示,采用t检验,计数资料用百分比表示,χ2检验,重复测量数据采用单因素方差分析,受试者工作特征曲线(receiver operating characteristic curve,ROC)评估血清CRP、NT-proBNP水平对重症肺炎的诊断价值,均以P<0.05为差异具有统计学意义。
2 结果
2.1 三组入院时一般情况比较
SP组、非SP组和对照组三组性别、年龄、吸烟史、高血压史和糖尿病史之间的差异均无统计学意义(P>0.05),三组白细胞计数值存在统计学差异(P<0.05),SP组白细胞计数明显非SP组和对照组,SP组白细胞计数高于对照组,差异有统计学意义(P<0.05),见表1。
表1. 三组入院时一般情况比较(n,%)( ±s)
±s)
|
组别 |
性别男(例) |
年龄(岁) |
吸烟史(例) |
高血压史(例) |
糖尿病史(例) |
白细胞计数(×109/L) |
|
SP组(n=35) |
22(62.86) |
76.13±4.79 |
20(57.14) |
12(34.29) |
9 (25.71) |
13.65±1.24*# |
|
非SP组(n=51) |
33(64.71) |
76.28±4.56 |
26(50.98) |
15(29.41) |
16 (31.37) |
10.88±0.69# |
|
对照组(n=40) |
28(70.00) |
75.98±3.69 |
18(45.00) |
13(32.50) |
11 (27.50) |
6.03±0.45 |
|
F |
0.476 |
0.053 |
1.102 |
0.243 |
0.359 |
830.951 |
|
P |
0.788 |
0.948 |
0.576 |
0.886 |
0.836 |
<0.001 |
注:与非SP组相比,*P < 0.05;与对照组相比,#P < 0.05。
2.2 三组入院时血清CRP、NT-proBNP水平比较
入院时SP组、非SP组和对照组三组血清CRP、NT-proBNP水平存在统计学差异(P < 0.05),SP组CRP、NT-proBNP水平明显高于非SP组和对照组,SP组CRP、NT-proBNP水平明显高于对照组,差异有统计学意义(P < 0.05),见表2。
表2. 三组入院时血清CRP、NT-proBNP水平比较( ±s)
±s)
|
组别 |
CRP(mg/L) |
NT-proBNP(pg/ml) |
|
SP组(n=35) |
90.86±15.62 |
3425.87±196.39 *# |
|
非SP组 (n=51) |
12.47±3.29 |
1233.51±85.81 # |
|
对照组(n=40) |
3.23±0.45 |
423.65±33.94 |
|
F |
1208.217 |
6378.756 |
注:与非SP组相比,*P < 0.05;与对照组相比,#P < 0.05。
2.3 SP组及非SP组不同时间CRP水平差异
SP组及非SP组CRP水平组间、时间以及交互差异均有统计学意义(P < 0.05),SP组患者治疗第3 d、第5 d以及第7 d时血清CRP水平均高于同期非SP组,差异有统计学意义(P < 0.05),见表3。
表3. SP组及非SP组不同时间CRP水平差异( ±s, mg/L)
±s, mg/L)
|
时间 |
SP组(n=35) |
非SP组(n=51) |
t |
P |
|
第3 d |
82.77±9.49 |
10.38±1.05 |
54.139 |
<0.001 |
|
第5 d |
69.48±7.23* |
8.11±0.87* |
60.147 |
<0.001 |
|
第7 d |
45.65±5.68*# |
6.03±0.79*# |
49.254 |
<0.001 |
|
F组间/P组间 |
86.920/<0.001 |
|
|
|
|
F时间/P时间 |
7.614/<0.001 |
|
|
|
|
F交互/P交互 |
4.824/<0.001 |
|
|
|
注:同组第3 d相比,*P < 0.05;与同组第5 d相比,#P < 0.05。
2.4 SP组及非SP组不同时间NT-proBNP水平差异
SP组及非SP组NT-proBNP水平组间、时间以及交互差异均有统计学意义(P < 0.05),SP组患者治疗第3 d、第5 d以及第7 d时血清NT-proBNP水平均高于同期非SP组,差异有统计学意义(P < 0.05),见表4。
表4. SP组及非SP组不同时间NT-proBNP水平差异( ±s, mg/L)
±s, mg/L)
|
时间 |
SP组(n=35) |
非SP组(n=51) |
t |
P |
|
第3 d |
2964.78±156.43 |
1085.94±68.99 |
54.139 |
<0.001 |
|
第5 d |
2148.16±120.65* |
876.73±59.17* |
60.147 |
<0.001 |
|
第7 d |
1565.88±94.78*# |
612.65±43.21*# |
49.254 |
<0.001 |
|
F组间/P组间 |
73.300/<0.001 |
|
|
|
|
F时间/P时间 |
22.960/<0.001 |
|
|
|
|
F交互/P交互 |
5.776/<0.001 |
|
|
|
注:同组第3 d相比,*P < 0.05;与同组第5 d相比,#P < 0.05。
2.5 血清CRP、NT-proBNP单项及联合检测重症肺炎的价值
血清CRP、NT-proBNP单项及联合对重症肺炎的诊断绘制ROC曲线,结果显示,CRP诊断重症肺炎的临界值为49.61 mg/L,曲线下面积为0.687,敏感度为54.55%,特异度为84.00%(P < 0.05),NT-proBNP诊断重症肺炎的临界值为2069.76pg/ml,曲线下面积为0.664,敏感度为100.00%,特异度为36.00%(P < 0.05),二者联合检测可提高预测效能,曲线下面积为0.701,敏感度为54.55%,特异度为85.33%(P < 0.05)。见表5、图1。
表5. 血清CRP、NT-proBNP单项及联合检测重症肺炎的价值
|
指标 |
Cut-off |
AUC |
敏感度 |
特异度 |
约登 指数 |
95%CI |
P |
|
CRP |
>49.61 mg/L |
0.687 |
54.55% |
84.00% |
0.386 |
0.512~0.863 |
0.044 |
|
NT-proBNP |
>2069.76 pg/ml |
0.664 |
100.00% |
36.00% |
0.360 |
0.516~0.812 |
0.035 |
|
联合 |
- |
0.701 |
54.55% |
85.33% |
0.399 |
0.534~0.868 |
0.023 |
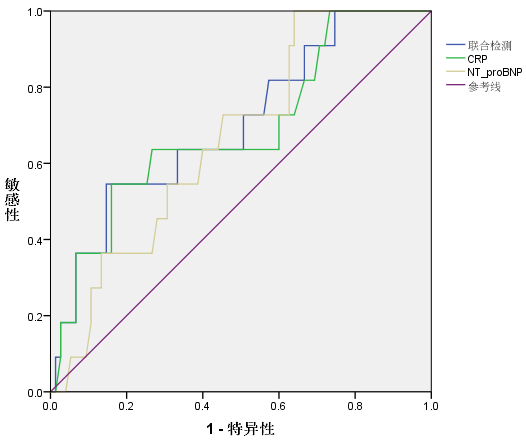
图1. 血清CRP、NT-proBNP单项及联合检测重症肺炎的价值
3 讨论
重症肺炎是临床病死率极高的危重症感染性疾病之一,患者受到病原体刺激引发全身性炎症反应,使得心、肝、肾以及中枢神经系统等全身多脏器器官损害和衰竭,最终导致死亡[10]。重症肺炎在有相关基础疾病以及老年人群中的发病率较高[11],早期重症肺炎缺乏典型临床特征和表现,发病后进展迅速且死亡率高[12],因此,对早期重症肺炎进行诊断和病情监测在管理和治疗患者时极其关键。基于此,本次实验探讨血清CRP和NT-proBNP在老年重症肺炎患者体内的变化情况,希望为重症肺炎患者的临床诊疗提供更多有效标志物。
血清CRP是能够在钙离子存在的前提下与肺炎链球菌荚膜C多糖发生沉淀反应的蛋白质,其在正常人体的含量一般不超过10 mg/L[13],在机体受到感染或炎症刺激尤其是急性感染刺激时快速升高,而当感染受到控制时其含量又可很快恢复[14]。NT-proBNP是含有76个氨基酸的N端残片分子,与BNP同时产生,但又较BNP更加稳定、血浆浓度更高、半衰期更长、变异性更低[15],相较于BNP来说检测效果更为理想,是欧美心脏学会推荐的评价心功能不全的唯一实验室指标[16],也被最新的一些研究发现是预测肺炎的理想标志物[17]。本次研究对健康老年人、肺炎老年人以及重症肺炎老年人血清中CRP和NT-proBNP水平进行比较,结果显示,入院时SP组CRP、NT-proBNP水平明显高于非SP组和对照组,SP组CRP、NT-proBNP水平明显高于对照组(P < 0.05)。SP组及非SP组CRP、NT-proBNP水平组间、时间以及交互差异均有统计学意义(P < 0.05),SP组患者治疗第3 d、第5 d以及第7 d时血清CRP、NT-proBNP水平均高于同期非SP组(P < 0.05)。这表明,CRP和NT-proBNP在不同肺炎严重程度的患者中含量不同,且随着临床治疗的开展呈下降趋势,可作为反映老年患者肺炎严重程度以及评估临床治疗效果的有效指标,这也与赵媛媛等人[18]的研究有相似结论。推测原因在于,老年重症肺炎患者受到外界病源刺激,机体分泌出大量的炎性因子,炎症局部巨噬细胞以及受到炎症因子刺激的干细胞开始合成并分泌出过量的CRP[19]。同时,老年重症肺炎患者多存在肺炎合并呼吸衰竭以及多种脏器衰竭,肺部感染严重影响了肺泡通气功能,机体处于低氧状态从而引起代谢及功能紊乱,增加心脏并发症以及心力衰竭发生风险,导致血清中NT-proBNP水平快速异常升高[20]。
为了进一步证实血清CRP、NT-proBNP在重症肺炎患者病情评估中的价值,本研究以血清CRP、NT-proBNP绘制重症肺炎诊断的ROC曲线,结果发现,CRP和NT-proBNP单独诊断重症肺炎的曲线下面积为0.687和0.664,二者联合检测对于重症肺炎的预测效能更佳,曲线下面积为0.701,敏感度为54.55%,特异度为85.33%。这提示,血清CRP和NT-proBNP对于重症肺炎患者病情的评估有着较高的诊断效能,可作为预测老年重症肺炎患者疾进展的有效标志物,且二者联合监测临床应用价值较好。
综上所述,与老年肺炎患者和健康老年人相比,老年重症肺炎患者血清中CRP及NT-proBNP含量显著升高,血清CRP和NT-proBNP水平对于诊断和评估老年重症肺炎患者病情严重程度有着重要价值,且二者联合检测诊断重症肺炎的效能更佳,能在早期发现并控制病情,辅助临床制定治疗计划,改善老年患者预后,值得临床推广使用。
参考文献
[2] Song Y, Yao C, Yao Y, et al. XueBiJing Injection Versus Placebo for Critically Ill Patients With Severe Community-Acquired Pneumonia: A Randomized Controlled Trial[J]. Crit Care Med, 2019, 47(9): e735-e743. doi: 10.1097/CCM.0000000000003842.
[3] Marin-Corral J, Pascual-Guardia S, Amati F,et al. Aspiration Risk Factors,Microbiology,and Empiric Antibiotics for Patients Hospitalized With Community-Acquired Pneumonia[J]. Chest, 2021, 159(1): 58-72. doi: 10.1016/j.chest.
[4] Gao N, Yan C, Zhang G. Changes of Serum Procalcitonin (PCT), C-Reactive Protein (CRP), Interleukin-17 (IL-17), Interleukin-6 (IL-6), High Mobility Group Protein-B1 (HMGB1) and D-Dimer in Patients with Severe Acute Pancreatitis Treated with Continuous Renal Replacement Therapy (CRRT) and Its Clinical Significance[J]. Med Sci Monit, 2018, 23; 24: 5881-5886. doi: 10.12659/MSM.910099.
[5] Shen S, Ye J, Wu X, et al. Association of N-terminal pro-brain natriuretic peptide level with adverse outcomes in patients with acute myocardial infarction: A meta-analysis[J]. Heart Lung, 2021, 50(6): 863-869. doi: 10.1016/j.hrtlng.
[6] 刘春, 邹勇 ,郭燕, 等. 重症肺炎所致ARDS患者血清cTnI、NT-proBNP及CRP水平变化及临床意义[J]. 分子诊断与治疗杂志, 2021, 13(7): 1154-1157. DOI:10.3969/j.issn.1674-6929.
[7] Modi AR, Kovacs CS. Hospital-acquired and ventilator-associated pneumonia: Diagnosis, management, and prevention[J]. Cleve Clin J Med, 2020, 87(10): 633-639. doi: 10.3949/ccjm.87a.19117.
[8] 中国医师协会急诊医师分会. 中国急诊重症肺炎临床实践专家共识[J]. 中国急救医学, 2016, 36(2): 97-107. DOI:10.3969/j.issn.1002-1949.
[9] Bakhshiani Z, Fouladi S, Mohammadzadeh S, et al. Correlation of sPD1 with Procalcitonin and C-Reactive Protein Levels in Patients with Sepsis[J]. Cell J, 2021, 23(1): 14-20. doi: 10.22074/cellj.
[10] Bielicki JA, Stöhr W, Barratt S, et al. Effect of Amoxicillin Dose and Treatment Duration on the Need for Antibiotic Re-treatment in Children With Community-Acquired Pneumonia: The CAP-IT Randomized Clinical Trial[J]. JAMA, 2021, 326(17): 1713-1724. doi: 10.1001/jama.
[11] Makhnevich A, Feldhamer KH, Kast CL, et al. Aspiration Pneumonia in Older Adults[J]. J Hosp Med, 2019, 14(7): 429-435. doi: 10.12788/jhm.
[12] Aydin M, Şaylan B, Ekiz İşcanlı İG. Factors associated with mortality in younger and older (≥75 years) hospitalized patients with community-acquired pneumonia[J]. Ann Saudi Med, 2022, 42(1): 45-51. doi: 10.5144/0256-4947.
[13] 窦红佳, 韩钧凌, 黄轶华. 不同剂量乌司他丁联合谷氨酰胺对老年胰腺炎治疗效果及CRP、PCT临床指标变化的影响[J]. 中国老年学杂志, 2023, 43(5): 1077-1079. DOI:10.3969/j.issn.1005-9202.
[14] Sproston NR, Ashworth JJ. Role of C-Reactive Protein at Sites of Inflammation and Infection[J]. Front Immunol, 2018, 9: 754. doi: 10.3389/fimmu.
[15] Sbolli M, deFilippi C. BNP and NT-proBNP Interpretation in the Neprilysin Inhibitor Era[J]. Curr Cardiol Rep, 2020, 22(11): 150. doi: 10.1007/s11886-020-01398-8.
[16] Cao Z, Jia Y, Zhu B. BNP and NT-proBNP as Diagnostic Biomarkers for Cardiac Dysfunction in Both Clinical and Forensic Medicine[J]. Int J Mol Sci, 2019, 20(8): 1820. doi: 10.3390/ijms20081820.
[17] 冯凯, 范贤明, 欧阳晓莉, 等. 不同病情老年社区获得性肺炎患者血清ALB、NT-proBNP、PTX3、SDC4的变化及对预后的影响分析[J]. 现代生物医学进展, 2023, 23(1): 152-157. DOI:10.13241/j.cnki.pmb.
[18] 赵媛媛, 王帅力, 高晓莉. 重症肺炎患儿血清PCT、IL-6、CRP、SAA水平变化及其与CK-MB、cTnT、NT-proBNP的相关性分析[J]. 检验医学与临床, 2022, 19(21): 2984-2987. DOI:10.3969/j.issn.1672-9455.
[19] 彭效芹,苏国德,卢太苓,等. 外周血WBC、ESR、CRP水平对难治性肺炎支原体肺炎患儿并发肝损害的预测分析[J]. 国际检验医学杂志,2023,44(3):346-350. DOI:10.3969/j.issn.1673-4130.
[20] 刘海红. 重症肺炎所致ARDS患者血NT-proBNP、CRP/ALB相关性及联合预测预后效能分析[J]. 中国急救复苏与灾害医学杂志, 2021, 16(10): 1133-1137. DOI:10.3969/j.issn.1673-6966.